注册证号 国药准字HJ20230118
注册证号备注 申请人应按照《药品标准物质原料申报备案办法》向中检院报送标准物质原料以及有关物质
的研究资料。
上市许可持有人英文名称 Pfizer Inc.
上市许可持有人地址(英文) 66 Hudson Boulevard East, New York, NY 10001 United States of America
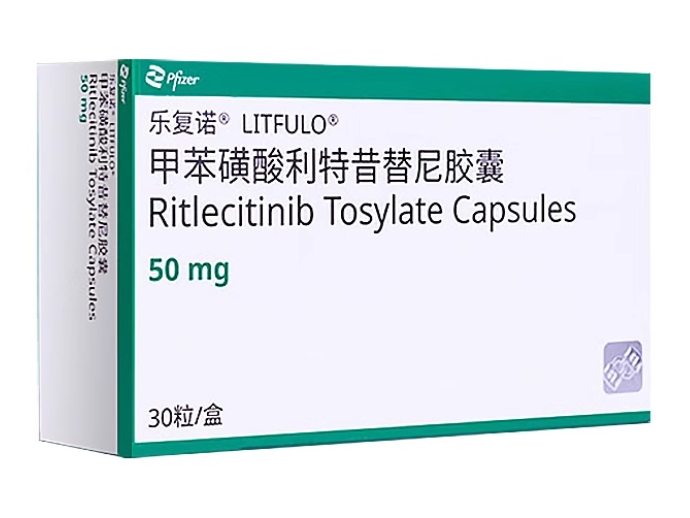
产品名称(中文) 甲苯磺酸利特昔替尼胶囊
产品名称(英文) Ritlecitinib Tosylate Capsules
商品名(中文) 乐复诺
商品名(英文) LITFULO
剂型(中文) 胶囊剂
规格(中文) 50mg(按C₁₅H₁₉N₅O计)
包装规格(中文) 30粒/盒
生产厂商(英文) Pfizer Manufacturing Deutschland GmbH
厂商地址(英文) Mooswaldallee 1, Freiburg im Breisgau 79090 GERMANY
厂商国家/地区(中文) 德国
厂商国家/地区(英文) GERMANY
发证日期 2023-10-18
有效期截止日 2028-10-17
药品本位码 86978718001605
产品类别 化学药品
摘要:甲苯磺酸利特昔替尼胶囊(国药准字HJ20230118)是经国家药品监督管理局注册的进口药品,适用于12岁及以上青
2024-01-06 09:08 评论:暂无评论
摘要:利特昔替尼胶囊上市后的产品名称为“甲苯磺酸利特昔替尼胶囊”,商品名为乐复诺/LITFULO。Pfizer Manufac
2024-01-06 09:04 评论:利特昔替尼胶囊上市国家药监局已经受理了,相信很快能买到了
摘要:辉瑞制药称其口服创新药物乐复诺®(通用名:甲苯磺酸利特昔替尼胶囊)在华获批一月余后,在中山大学附属
2023-12-05 12:32 评论:暂无评论
更多相关:乐复诺 甲苯磺酸利特昔替尼胶囊 LITFULO 利特昔替尼



